Cet article fait partie d'un ensemble de ressources élaborées par l'académie de Strasbourg pour Enseigner avec le numérique, proposant des articles sur :
Un article d'introduction et de présentation de ce dossier est disponible ici : Introduction à l'utilisation du numérique en SVT
Recueillir une base de données et Utiliser un tableur de manière collaborative en TP (exemple de la cinétique enzymatique) - niveau prise en main

Thème numérique : Base de données / ExAO/ Tableur / Travail collaboratif
Thème pédagogique : Activité et Cinétique enzymatique
Niveau : 1ère spé SVT
Partie du Programme :
La Terre, la vie et l’organisation du vivant
• Transmission, variation et expression du patrimoine génétique.
Les enzymes, des biomolécules aux propriétés catalytiques
Connaissances : Les protéines enzymatiques sont des catalyseurs de réactions chimiques spécifiques dans le métabolisme d’une cellule.
Notions fondamentales : catalyse, substrat, produit
• Capacités : étudier l’interaction enzyme-substrat en comparant les vitesses initiales des réactions et faisant varier soit la concentration en substrat ; soit en enzyme. Utiliser des tangentes à t0 pour calculer la vitesse initiale.
But pédagogique :
- Savoir mettre en évidence une activité enzymatique et déterminer la vitesse initiale d’une réaction enzymatique à l’aide d’un dispositif ExAO : élaboration d’une base de données,
- Mettre en évidence l’influence de la concentration du substrat sur la vitesse initiale de la réaction enzymatique : utilisation de la base de données générée de manière collaborative sur tableur en ligne.
Place du Numérique :
- Usage des outils numériques généralistes (tableurs -collaboratifs-)
- Usage de l’expérimentation assistée par ordinateur (ExAO)
- Élaboration et usage des bases de données
- Calculs quantitatifs
Avantages du numérique :
| Avec utilisation de l’outil numérique | avantages | Sans l'utilisation de l'outil numérique | avantages |
|
Mesure de la transmittance par ExAO, tracé automatique du graphique souhaité |
Gain temps |
Mesure de la transmittance par sonde. Relevé des valeurs et tracé du graphique de manière classique |
Travail du graphique |
|
Utilisation d’un tableur en ligne, travail collaboratif. Chaque binôme ne fait qu’une mesure et n’entre que sa valeur. Possibilité d’utilisation d’un tableur classique (non collaboratif). Chaque binôme ne fait qu’une mesure mais doit ensuite relever et entrer les valeurs de tous les autres binômes dans son tableur.
|
Gain temps
Éviter une tâche répétitive
Gain de temps moins marqué
|
Relever la vitesse initiale pour différentes concentrations de substrat.
|
Maîtrise de la manipulation (Répétitif)
|
Pré acquis :
Les élèves ont déjà vu :
- Les protéines
- La notion d’enzyme, la réaction enzymatique, la double spécificité de substrat et de réaction
- Exemple déjà traité : Enzyme : AMYLASE, Substrat : amidon, Produit : maltose
- Amidon : glucide complexe, maltose glucide simple
- Réactif : Lugol ou eau iodée : met en évidence la présence d’amidon (bleu)
Déroulement simplifié de la séance :
► Fiche Séance Complète Professeur en annexe
- On présente le but de la séance : on souhaite, grâce à la mise en évidence de l’activité enzymatique de l’amylase, déterminer la vitesse à laquelle cette réaction se déroule (cinétique enzymatique) et déterminer de quels facteurs elle peut éventuellement dépendre.
La notion de vitesse de réaction est donc nouvelle et est à mettre en avant.
- On rappelle la réaction mise en jeu.
- On demande aux élèves de réfléchir à une manière simple de mettre en évidence, de manière visible, l’hydrolyse de l’amidon.
○ Décoloration eau iodée (bleu→jaune)
○ Vitesse de la réaction d’hydrolyse de l’amidon se détermine en relevant la quantité d’amidon (substrat) hydrolysée en fonction du temps.
Rappel pour les élèves :
On donne la définition de vitesse de réaction et vitesse initiale et la méthode de détermination graphique.
- Quantifier la disparition d’amidon (ou apparition de maltose) ?
Aborder la notion de mesure de transmittance par colorimètre.
Remarque : L’utilisation du colorimètre ou spectrophotomètre est au programme de Physique-Chimie en 1ère spé où ils découvrent la loi de Beer-Lambert. On peut s’arranger pour faire ce TP après les collègues de Physique-Chimie. Une partie de nos élèves auront alors déjà des notions intéressantes afin de gagner du temps.
⇒ Déterminer par ExAO équipé d’un colorimètre, la vitesse d’hydrolyse de l’amidon (vitesse de décoloration) par l’amylase en mesurant l’évolution de la transmittance de la solution (amidon + amylase + eau iodée) en fonction du temps.
- Les élèves déterminent ce dont ils ont besoin et élaborent un protocole.
⇒ Les facteurs à faire varier :
o La concentration en Substrat : AMIDON
o La concentration en Enzyme : AMYLASE
Dans cette séance il a été choisi de ne faire varier que la concentration en substrat.
Chaque groupe fera donc son expérience avec des concentrations en substrat = AMIDON différentes.
| Groupes | Concentration de la solution d'AMIDON % |
| 1 | 0,8 % |
| 2 | 0,6 % |
| 3 | 0,4 % |
| 4 | 0,2 % |
| 5 | 0,08 % |
| 6 | 0,06 % |
| 7 | 0,02 % |
| 8 | 0,01 % |
Chaque groupe obtient un graphique ExAO.
Exemple graphique ExAO élève :
Pour une concentration d’AMIDON de 0,8%
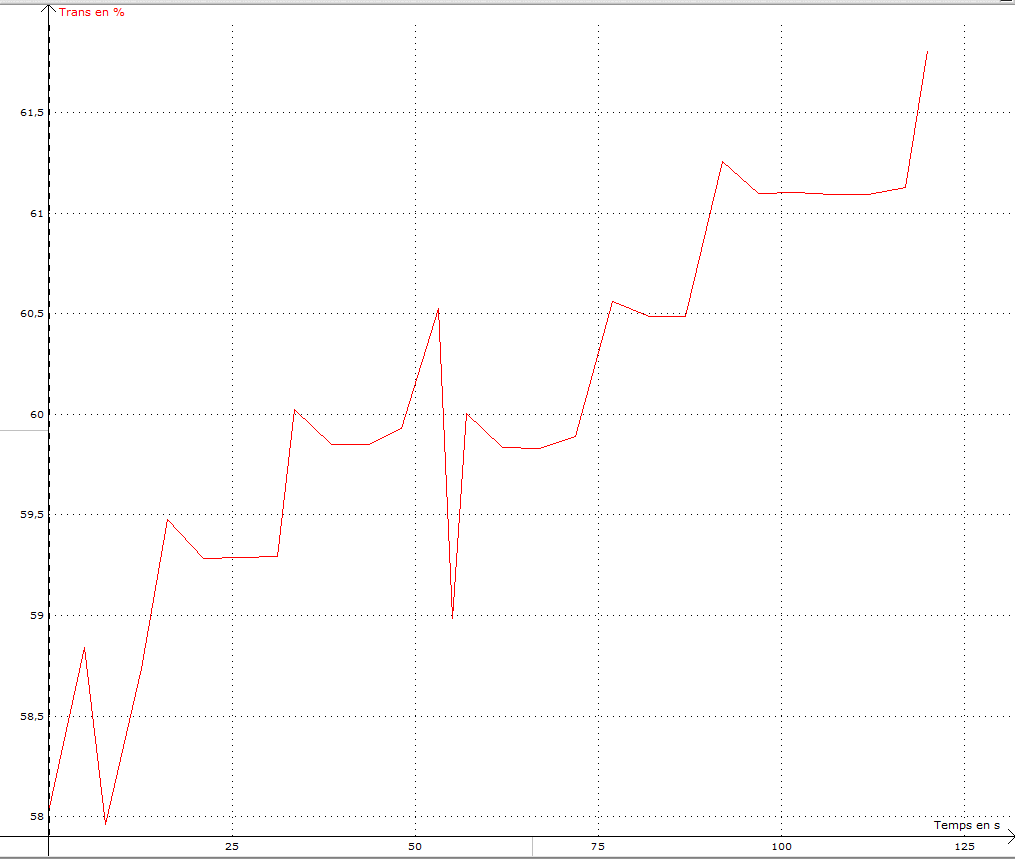
Variation de la Transmittance (%) en fonction du temps (s)
Chaque groupe calcule la vitesse initiale de sa réaction (base de données élaborée par le groupe). Pour ce faire chaque binôme relève les valeurs nécessaires sur son graphique ExAO puis entre dans un tableur en ligne préalablement mis en ligne par le professeur les valeurs lui permettant de calculer la vitesse initiale.
La vitesse initiale de la réaction dans cet exemple est déterminée ainsi (% transmittance t = 25 sec - % transmittance t = 0 sec) /25 sec en UA. Ces valeurs sont relevées sur le graphique ExAO.
Le delta temps est ici déterminé par le professeur. Le delta temps choisi pour déterminer la vi dépend des concentrations utilisées en amidon. Il s’agit de faire un test au préalable et de modifier le cas échéant cette valeur.
|
Concentration amidon % |
Transmittance à T=0 s |
Transmittance à T=25 s |
Vitesse initiale |
|
0,01 |
|
|
|
|
0,02 |
|
|
|
|
0,06 |
|
|
|
|
0,08 |
|
|
|
|
0,2 |
|
|
|
|
0,4 |
|
|
|
|
0,6 |
|
|
|
|
0,8 |
|
|
|
Exemple tableur élève en ligne : collaboratif : ensemble de la classe
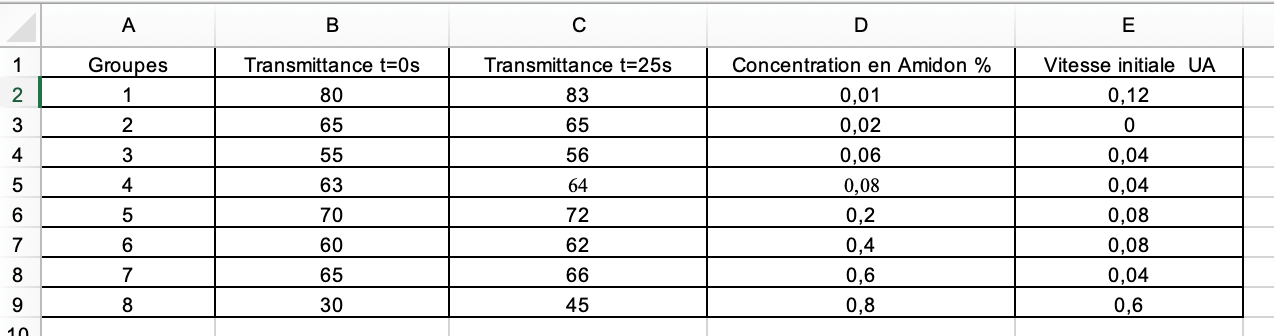
Chaque groupe ne complète que sa ligne et voit apparaître en simultané les résultats des autres sur sa feuille à l’écran. (Ce que ne permet pas le tableur non en ligne où il faudrait reporter la valeur de chaque groupe après une mise en commun.)
Tracer en ligne le graphique de l’évolution de la vitesse initiale (UA) de la réaction (l’hydrolyse de l’amidon par l’amylase) en fonction de la concentration en substrat.
Exemple de graphique en ligne obtenu par la classe de manière collaborative :
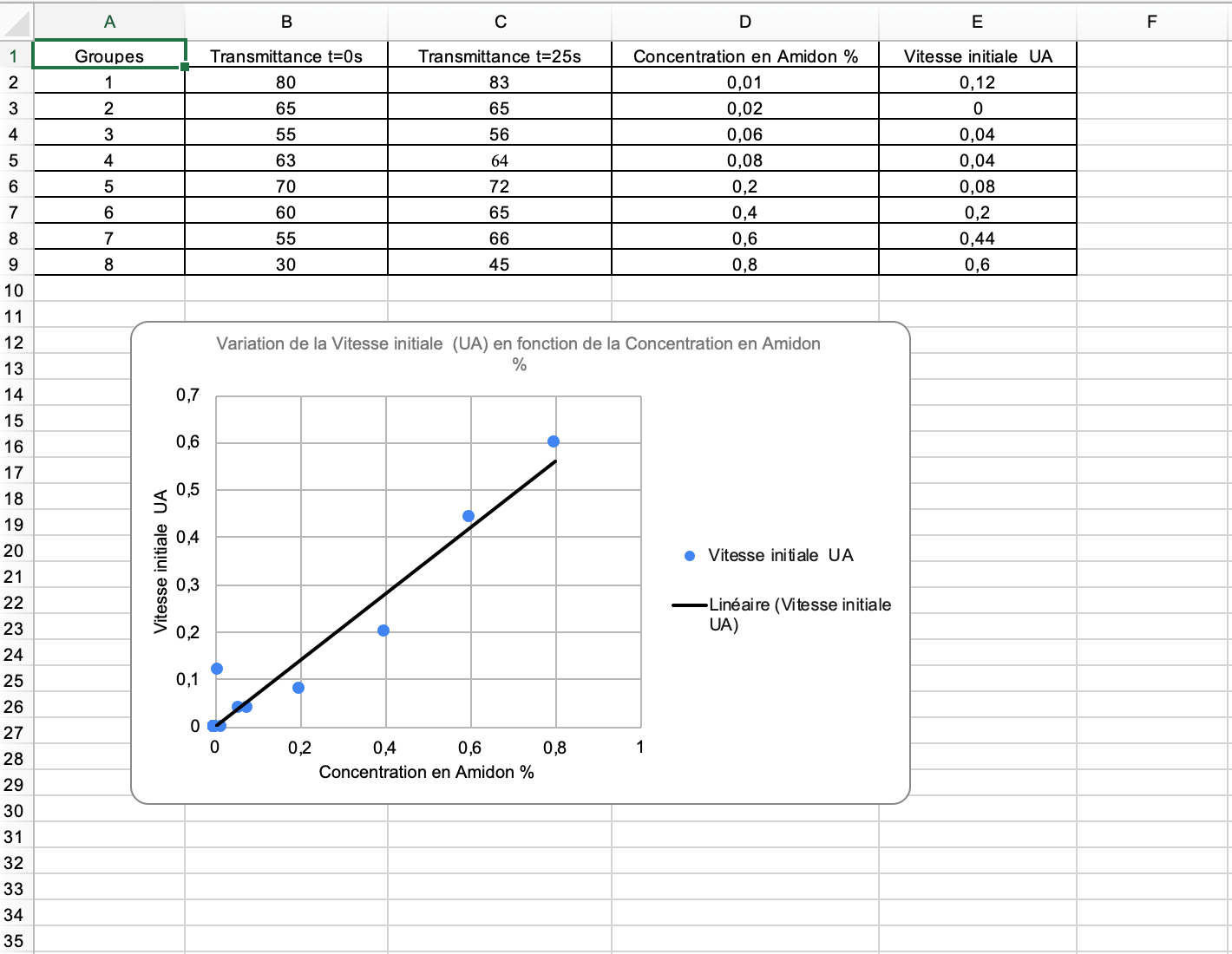
Version en ligne
Le document est ici uniquement accessible en lecture seule. Pour que vos élèves puissent le compléter, vous devez paramétrer cela lors de la création de votre document.
- Conclusion : indiquer l’impact de la concentration en substrat sur la vitesse de réaction enzymatique.
Sources :
Site de Didier Poll (plus disponible en ligne)
http://biochimej.univ-angers.fr/Page2/COURS/Zsuite/3BiochMetab/5EntreeAutresOses/1EntreeAutOses.htm
Nathan SVT TermS 2012 p 116-117
http://eric.lacouture.free.fr/lycee/termS_spe/cours_term_spe_ch8.htm