Cet article fait partie d'un ensemble de ressources élaborées par l'académie de Strasbourg sur la thématique de la pensée critique, proposant
Des pistes au quotidien  , Des activités ciblées
, Des activités ciblées  , Des parcours pour approfondir
, Des parcours pour approfondir  et une Boîte à outils
et une Boîte à outils 
Vous pouvez accéder aux autres ressources en cliquant sur le lien suivant : 
Quantifier le microbiote cutané en seconde à l’aide d’une activité pratique
-
En lien avec la ressource « Le professeur de sciences et le B.O. : microbiote humain et santé - notion n°1 » cette activité a pour objectif de comprendre comment les scientifiques ont pu quantifier le microbiote de la peau. Une activité pratique est proposée en prenant en compte les restrictions liées à la réglementation à suivre pour les séances de TP en lycée
-
Intentions
En lien avec la ressource « Le professeur de sciences et le B.O. : microbiote humain et santé - notion n°1 » cette activité a pour objectif de comprendre comment les scientifiques ont pu quantifier le microbiote de la peau. Une activité pratique est proposée en prenant en compte les restrictions liées à la réglementation à suivre pour les séances de TP en lycée afin de faire concevoir par les élèves des protocoles expérimentaux permettant d’échantillonner et quantifier un microbiote.
L’étude du microbiote cutané
Parmi les capacités à travailler selon le B.O., un élève doit pouvoir calculer la proportion de microbes présents dans un individu par rapport à son nombre de cellules. La quantification du microbiote cutané peut être réalisée de façon approximative en observant un cliché de microscopie électronique à balayage de la surface de la peau (cf. figure 1) et en prenant en compte l’échelle et la surface de la peau (en moyenne pour un homme adulte de 70 kg, elle est de 2 m2). Si le cliché est bien choisi, l’élève pourra trouver un ordre de grandeur de 1011 bactéries. En complétant cette valeur avec d’autres données concernant les autres microbiotes (voir la ressource présentée dans les pistes au quotidien), il sera possible de la comparer au nombre de cellules d’un être humain. Cependant cette méthode ne permet pas de faire travailler l’élève de façon critique sur un cas concret. En effet, aucun argument ne permet de définir la microphotographie choisie comme représentative et la situation ne reflète pas les enjeux actuels de l’étude des microbiotes.

La réglementation à suivre pour une activité pratique
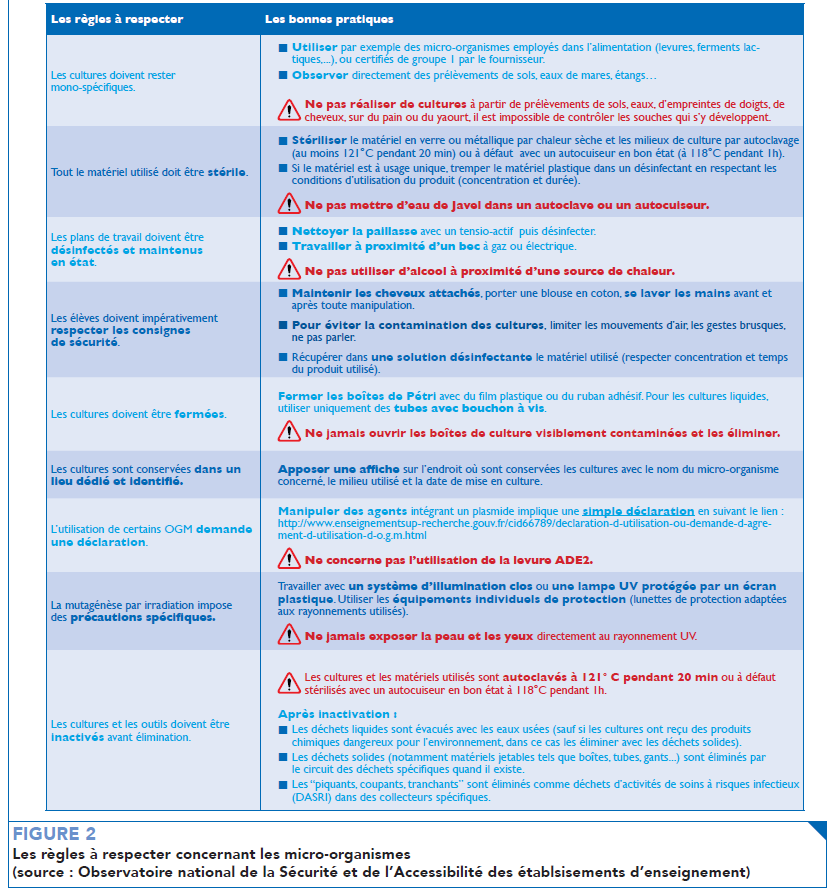
Selon la réglementation, toute empreinte palmaire est interdite. Par ailleurs, toute culture n’étant pas monospécifique est également proscrite (cf. figure 2). La réalisation d’une séance de travaux pratiques avec les élèves nécessite donc de faire de nombreux compromis. Malgré tout, des manipulations intéressantes peuvent être envisagées afin de faire réfléchir les élèves au sujet des méthodes permettant d’échantillonner et quantifier un microbiote.
Un substitut pour exercer son esprit critique lors de l’étude d’un microbiote
Selon la réglementation, toute empreinte palmaire est interdite. Par ailleurs, toute culture n’étant pas monospécifique est également proscrite (cf. figure 2). La réalisation d’une séance de travaux pratiques avec les élèves nécessite donc de faire de nombreux compromis. Malgré tout, des manipulations intéressantes peuvent être envisagées afin de faire réfléchir les élèves au sujet des méthodes permettant d’échantillonner et quantifier un microbiote.
Des méthodes d’échantillonnage possibles et leurs biais
Plusieurs méthodes susceptibles d’êtres proposées par les élèves sont présentées dans la figure 3.
- Le prélèvement de la croûte (équivalent de la biopsie de la peau)
Le prélèvement et l’observation de la croûte est l’alternative la plus simple à imaginer. Les élèves s’étant rendu compte que son observation au microscope optique n’est pas possible du fait de la difficulté à réaliser une coupe fine et que l’observation à la loupe n’apporte pas la précision nécessaire, il est possible de proposer des microphotographies au MEB.
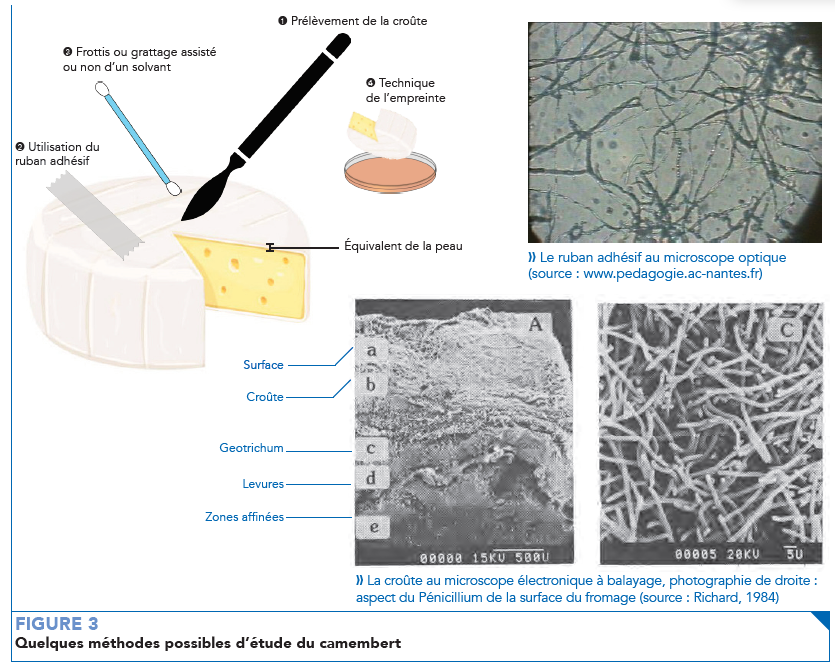
Les photos (cf. figure 3) permettent de se rendre compte que Penicillium camberti et Geotrichum candidum ne forment pas une couche mais bien plusieurs couches de micro-organismes. Le dénombrement est donc impossible. La problématique est la même pour la peau et peut être illustrée également par des microphotographies (cf. figures 1 et 4).

- La technique du ruban adhésif ou de l’empreinte (équivalent de la plaque de contact pour la peau)
La technique du ruban adhésif est décrite sur le site pédagogique de l’académie de Nantes. Elle permet d’observer une couche de micro-organismes. Puisque le prélèvement est superficiel, il ne permet donc pas de dénombrement. Par ailleurs, l’observation n’est pas aisée. Cette technique devrait être couplée à des techniques de culture (cf. infra) pour mieux détecter les micro-organismes mais le problème principal ne serait quand même pas réglé.
Celle de l’empreinte a le même inconvénient que celle du ruban adhésif. Par ailleurs, la boîte de Pétri utilisée contenant un milieu de culture sélectif ne permettra que de voir une partie des micro-organismes d’intérêt (cf. figure 5). Cette méthode est plus proche de celle utilisée en réalité pour la peau (la méthode de la plaque de contact). À noter que malgré le manque de rigueur pour dénombrer des micro-organismes, cette méthode est fréquemment utilisée dans les études du microbiote cutané car elle a l’intérêt d’être rapide dans son utilisation.
Précisons également que ces cultures sont interdites en lycée car elles ne restent pas monospécifiques. Cependant, il est possible de passer par un laboratoire d’analyse. En effet il pourra garantir le caractère non pathogène des cultures obtenues et pourra également les sceller avant livraison.
Les cultures peuvent être réalisées également à partir de morceaux de fromage mais le développement excessif des thalles ne permettra pas d’analyse (cf. figure 5), ou à partir d’un broyat de fromage dilué dans de l’eau stérile.
- Les techniques de frottis et de grattage assistées ou non de l’utilisation d’un solvant (équivalent de la méthode du frottis et de celle de Williamson-Kligman et de ses variantes pour la peau)
Ces techniques sont efficaces car elles permettent de prélever la quasi-totalité des micro-organismes. Celles utilisant un solvant sont encore plus performantes. Les prélèvements pourront ensuite être placés sur un milieu de culture.
Quelque-soit la méthode de prélèvement choisie, l’observation du résultat d’une culture sous forme de photographie (cf. figure 5) ou de boîte scellée dont la culture a été réalisée dans un laboratoire d’analyse privé, les élèves pourront constater le développement de colonies qu’ils pourront définir comme des unités de mesure. Cette unité correspond à celle utilisée notamment pour l’étude du microbiote cutané et est nommée CFU (colony forming unit). L’appréciation par les élèves de cette situation concrète leur permettra de mieux comprendre les résultats publiés dans les revues scientifiques.
Notons que seules les techniques de frottis ou grattage permettent d’obtenir des colonies qui résultent de la croissance d’un micro-organisme. En effet ces méthodes permettent la dissociation des colonies de micro-organismes de la peau/camembert alors que la méthode du ruban adhésif ou de l’empreinte ne séparent pas les micro-organismes.

Le cas de la peau
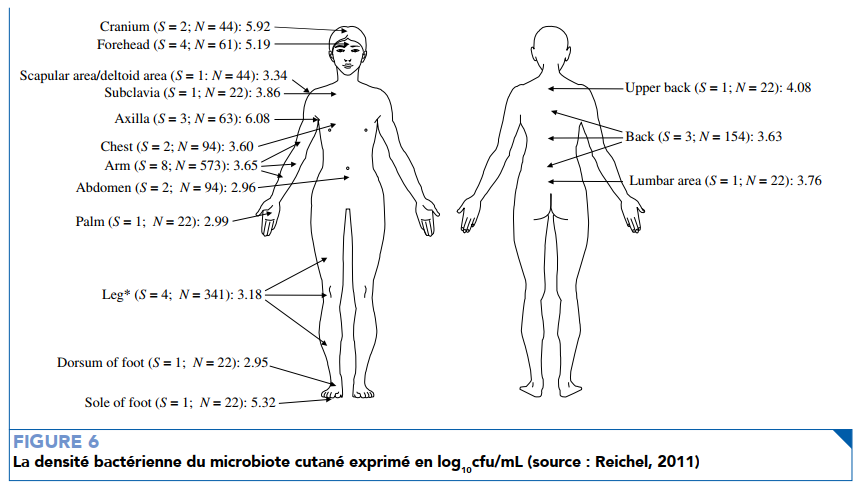
Une fois que les élèves auront pu se rendre compte des difficultés et intérêts de chaque méthode de prélèvement et de comptage pour le camembert, les limites de ce substitut par rapport à la peau pourront être abordées. La principale différence est que les moisissures sont pluricellulaires et peuvent atteindre une taille importante (300 à 800 µm de longueur pour les conidiophores). Par ailleurs, une problématique importante de l’échantillonnage ne peut pas être appréciée à l’aide de ce modèle et doit être complétée par des photos ; il s’agit de la répartition hétérogène des micro-organismes à la surface de la peau. En effet, les moisissures sont réparties de façon assez uniforme à la surface du camembert alors qu’au niveau de la peau la densité bactérienne varie entre 102 cellules/cm2 et 107 cellules/cm2 en fonction des sites. Le principal facteur qui contrôle ces variations est la densité de glandes sébacées, eccrines et apocrines. Il est possible d’aborder ce sujet en proposant un document présentant des estimations de la densité bactérienne en fonction des sites au niveau de la peau (cf. figure 6).
L’intérêt de l’activité pour comprendre l’état actuel des connaissances au sujet du microbiote
Le sujet du microbiote cutané abordé ici sous forme d’une activité permet d’aborder la problématique de l’étude des microbiotes de façon plus générale. Des compromis entre le temps mis pour appliquer les protocoles et la précision des données obtenues doivent être faits.
Mise en pratique en classe
L’activité a été testée en classe par Eric Trehiou. En s’adressant à un laboratoire d’analyse et en utilisant les milieux de culture commandés aux entreprises dont les liens sont indiqués ci-dessous, sa classe de seconde a pu obtenir des résultats similaires à ceux présentés dans la figure 5.
Les milieux utilisés lors du test avec des élèves de seconde :
http://www.grosseron.com/oo/Assets/client/FTP/GROSSERON/FT/FT9100071.pdf
https://www.humeau.com/media/blfa_files/__TC_370-oeabouraud-CMP_FR_030315_74703137002.pdf
Conclusion
Cette activité pratique permettra aux élèves d’adopter un esprit critique lorsqu’ils interpréterons des données chiffrées. Dans nos enseignements, les occasions de réaliser des mesures avec un esprit critique sont assez rares et les élèves sont souvent confrontés à des données dont ils n’ont aucune idée de l’origine. Ils pensent alors que les sciences produisent des données chiffrées facilement. En travaillant plus souvent sur la conception de protocoles de collecte de données, ils pourront à terme mieux comprendre pourquoi les « fake news » sont plus nombreuses et faciles à produire que des arguments scientifiques.
RÉFÉRENCES
- Malcolm, The demonstration of bacteria on and within the stratum corneum using scanning electron microscopy, British journal of Dermatology, 1980
- Masako, A novel method to control the balance of skin microflora Part 1. Attack on biofilm of Staphylococcus aureus without antibiotics, Journal of Dermatological Science, 2005a
- Masako, A novel method to control the balance of skin microflora Part 2. A study to assess the effect of a cream containing farnesol and xylitol on atopic dry skin, Journal of Dermatological Science, 2005b
- Reichel, Identification of variables for aerobic bacterial density at clinically relevant skin sites, Journal of Hospital Infection, 2011