Cet article fait partie d'un ensemble de ressources élaborées par l'académie de Strasbourg sur la thématique de la pensée critique, proposant
Des pistes au quotidien  , Des activités ciblées
, Des activités ciblées  , Des parcours pour approfondir
, Des parcours pour approfondir  et une Boîte à outils
et une Boîte à outils 
Vous pouvez accéder aux autres ressources en cliquant sur le lien suivant : 
Aborder au collège le sujet de la sécurité des vaccins anti-Covid.
-

-
 Aborder le sujet de la sécurité des vaccins anti-Covid au collège devient presque un incontournable face à la tempête médiatique ayant fait suite à la pandémie de Covid-19. Une bande dessinée créée dans le cadre de cette ressource sert de point d’accroche et de réflexion facile d’accès aux élèves.
Aborder le sujet de la sécurité des vaccins anti-Covid au collège devient presque un incontournable face à la tempête médiatique ayant fait suite à la pandémie de Covid-19. Une bande dessinée créée dans le cadre de cette ressource sert de point d’accroche et de réflexion facile d’accès aux élèves. -
Intentions :
Aborder le sujet de la sécurité des vaccins anti-Covid au collège devient presque un incontournable face à la tempête médiatique ayant fait suite à la pandémie de Covid-19. Une bande dessinée créée dans le cadre de cette ressource sert de point d’accroche et de réflexion facile d’accès aux élèves.
Introduction
En vue de permettre à nos élèves de travailler de façon concrète sur un sujet d’actualité, nous pouvons nous saisir de l’opportunité offerte par la tempête médiatique autour de la vaccination anti-Covid. Cette occasion d’exercer son esprit critique permettra aux élèves de découvrir que cette démarche ne les concerne pas uniquement en tant qu’individu mais également en tant que membre d’une société. Cette activité leur permettra aussi de mieux comprendre que cet exercice favorise des choix mieux informés.
Cette ressource n’a pas l’ambition de présenter des activités clé en main mais plutôt de fournir un point d’accroche cadré au sujet de la sécurité des vaccins anti-Covid. Il faut garder à l’esprit que le sujet de la Covid peut être source d’inquiétude pour la jeunesse mais la connaissance d’un certain nombre de faits scientifiques pourra apporter un éclairage indispensable à la construction d’une opinion construite au sujet de la vaccination et lutter contre certaines craintes.
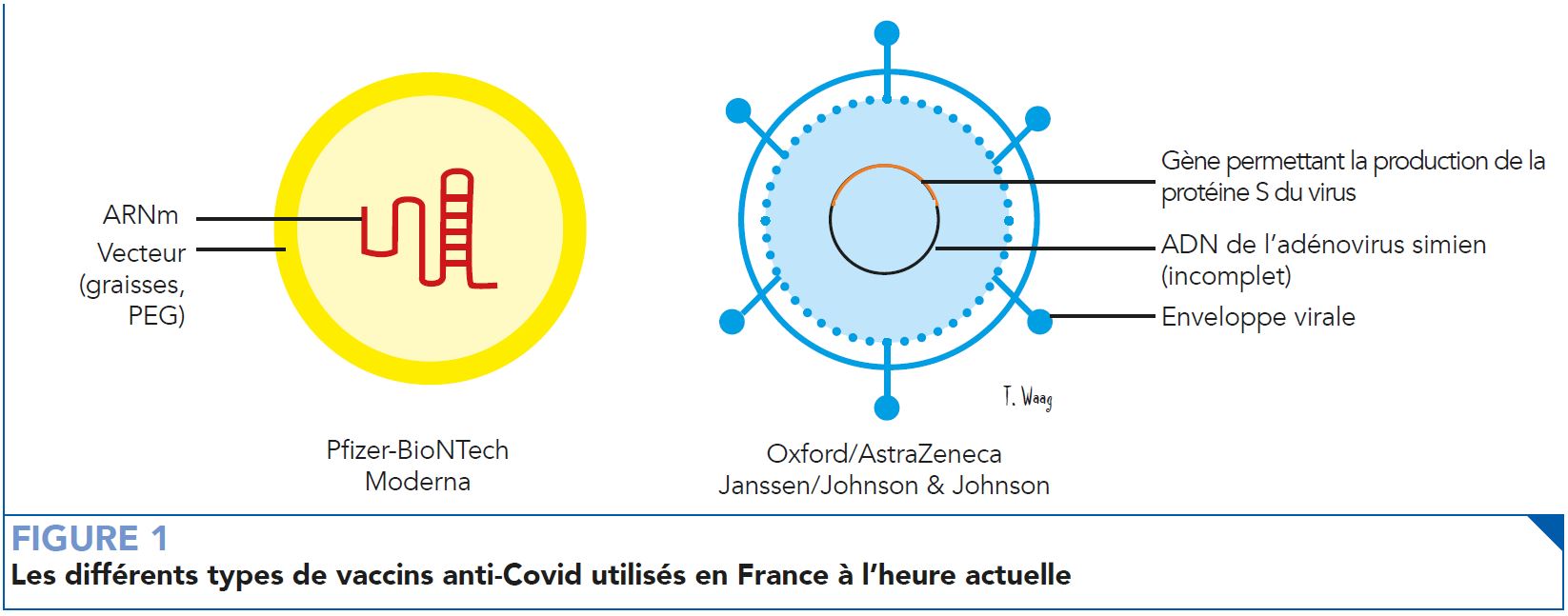
Ainsi cette ressource propose un exposé scientifique au sujet de la sécurié des vaccins anti-Covid basés sur les technologies à ARNm à vecteur non vivant ainsi que sur celles à vecteur viral inactivé qui sont les deux solutions qui avaient été envisagées en France même si la deuxième solution n’est plus tout à fait d’actualité et que d’autres choix sont aussi à l’étude (voir figure 1). Certains faits présentés dans ce court exposé ont servi à construire les réponses proposées par le médecin dans la bande dessinée.
Une revue de la littérature nécessaire pour l’enseignant qui souhaite aborder le sujet de la vaccination anti-covid en classe
Aujourd’hui nous faisons face à une situation sanitaire inédite du fait de l’émergence d’une nouvelle souche de coronavirus à l’origine d’une pandémie mondiale, mais aussi du fait de la nécessité de construire une immunité collective le plus rapidement possible.
Une crainte compréhensible provoque encore une certaine méfiance en France. Afin de choisir de se faire vacciner en connaissance de cause on s’appuiera ici sur des faits scientifiques. Quelques questions fondamentales au sujet de la sécurité des vaccins à acides nucléiques vont être abordées ici.
Quels vaccins sont-ils actuellement disponibles en France ?
À l’heure d’aujourd’hui, quatre vaccins ont été utilisés en France. Celui de Pfizer-BioNTech, de Moderna, d’AstraZeneca et de Johnson & Johnson. Les deux premiers sont basés sur la technologie d’ARNm contenu dans un vecteur non vivant constitué de différentes graisses. Les derniers quant à eux consistent en un vecteur viral vivant non réplicatif qui contient un gène permettant la production d’une protéine du coronavirus en plus du matériel génétique incomplet d’un autre virus inoffensif pour l’Homme (adénovirus simien).
Les vaccins ont-ils été conçus trop rapidement ?
La période normale de 2-5 ans nécessaire à l’évaluation de la sécurité des vaccins1 n’a pu être respectée. Cependant les vaccins contre le coronavirus ont tous été soumis à un même protocole d’essais cliniques qui respecte les étapes permettant d’établir la sécurité d’un vaccin2. Il est toutefois souvent fait mention à travers les médias de la nécessité d’études épidémiologiques sur de nombreuses années pour vraiment évaluer la sûreté des vaccins. En réalité, cette longue période dont on parle est celle nécessaire pour établir un lien de causalité entre des effets suspectés et la vaccination. Ainsi, s’il n’y a pas d’effets secondaires mis en évidence sur une période compatible avec le mode d’action des vaccins, cette longue et fastidieuse recherche de causalité n’a pas lieu d’être.
La difficulté reste toutefois de bien apprécier l’échelle de temps des effets de la vaccination. Concernant les vaccins traditionnels, les effets à long terme ont été suivis par le biais de longues études épidémiologiques mais également par la recherche de mécanismes biologiques possibles. Les effets concernés sont les réactions allergiques retardées et le développement de maladies auto-immunes3. Les périodes maximales s’étendraient donc sur 6 semaines4. Les résultats des essais cliniques et la surveillance en cours des personnes vaccinées dans le monde lèvent ainsi beaucoup de doutes sur d’éventuels risques5,6,7.
Quelques médias ont tenté d’alerter leurs lecteurs sur de possibles effets de la vaccination à très long terme. De tels effets auraient été envisagés par le passé au sujet de la survenue d’asthme, allergies, diabètes ou encore de cancers8. Toutefois il est important d’avoir à l’esprit qu’aucune étude n’est parvenue à établir un lien de causalité9.
Pour finir, les technologies vaccinales à ARNm qui semblent avoir rapidement vu le jour sont basées sur des recherches sur les souris remontant au moins à 199310 et qui ont été poursuivies lors d’études au sujet du virus de la grippe, de la rage, Zika, Ebola, du VIH et du cytomégalovirus humain11. Concernant la vaccination basée sur l’utilisation d’ADN, les premiers essais chez l’humain dateraient de 199812.
Les vaccins à acides nucléiques peuvent-ils altérer de façon permanente le fonctionnement de nos cellules ?
Les vaccins comme ceux de Pfizer et de Moderna sont basés sur la technologie à ARNm. Les connaissances au sujet de l’utilisation des ARNm par les cellules sont suffisantes pour s’assurer que ces molécules ne demeurent pas beaucoup plus d’une journée dans le corps12. Les effets sont ensuite relayés par les cellules du système immunitaire tout comme les vaccins traditionnels. Les incertitudes pourraient concerner les antigènes qui seraient adressés à des cellules autres que celles ciblées par le vaccin. C’est en effet une éventualité à envisager pour les vaccins de Pfizer et de Moderna notamment. Toutefois, ces cellules exprimant des antigènes étrangers au corps seraient alors rapidement détruites par les cellules immunitaires13. Des spéculations concernant l’intégration des ARNm sont parfois proposées14,15,16. Très peu de données viennent les alimenter et il semble peu plausible d’un point de vue théorique, à l’heure actuelle, que ce soit possible17.
Concernant les vaccins basés sur de l’ADN, l’OMS recommande que des études au sujet du risque d’intégration au génome soient réalisées18,19. Des expériences ont toutefois déjà été réalisées pour mesurer l’intégration d’ADN suite à une injection intramusculaire. Ces injections ont rarement entraîné la persistance à long terme d’ADN20.
Quand bien même, un risque d’intégration serait à prendre en considération, n’oublions pas qu’il n’excèderait pas celui auquel nous sommes exposés à chaque instant au cours de notre vie. En effet, des études ont révélé la présence d’ADN et ARN viraux dans le sang de tout individu sans signe de maladie. Par ailleurs, certaines séquences (du virus de l’hépatite C) se sont révélées avoir été intégrées au génome humain de ces individus sains chez qui l’étude a été réalisée21. Ainsi, si l’on venait à considérer, malgré tout, d’un point de vue théorique que la vaccination nous exposait ponctuellement à un risque d’intégration, il serait obligatoirement infime et encore plus minimisable si on le confrontait aux risques liés à une exposition avérée au coronavirus.
Les vecteurs sont-ils dangereux pour la santé ?
Contrairement aux médicaments, les excipients représentent un contributeur majeur aux réactions immédiates associées aux vaccins2. Les vaccins à ARNm peuvent entrer dans nos cellules grâce à une capsule de nanoparticules. Un des constituants de cette capsule, le PEG serait suspecté de provoquer des réactions anaphylactiques, particulièrement suite à des expositions répétées22. Selon le CDC23, six cas de réaction anaphylactique ont été enregistrés sur 272 001 vaccinations aux USA. Cette valeur est à comparer à celle habituellement constatée de moins de un cas pour 1 million pour des vaccins traditionnels2. Des effets secondaires importants avaient également été constatés plus fréquemment pour une seconde dose vaccinale lors des essais cliniques réalisés pour le vaccin de Moderna24. Si le risque est avéré, la balance bénéfices-risques penche toujours très largement du côté des bénéfices. Il faut bien avoir conscience que les cas de réaction anaphylactique mentionnés ont tous été traités et qu’aucun n’a eu de conséquences graves grâce à la prise en charge du personnel médical formé pour cette vaccination.
Le vaccin d’Astrazeneca fait intervenir un adénovirus simien qui n’a aucun effet chez l’humain. Par ailleurs, les séquences d’ADN lui permettant sa réplication lui ont été retirées. Un des seuls risques envisageables liés à l’usage d’un tel vecteur ne pourrait concerner que son potentiel à stimuler une réaction immunitaire inappropriée. Comme tout élément étranger au corps qui pénètre dans le milieu intérieur (par l’intermédiaire d’un vaccin mais aussi d’un micro-organisme, d’un aliment que nous mangeons...), des réactions immunitaires visant la personne (réactions auto-immunes) ou produisant des cellules immunitaires inadaptées peuvent survenir. Les réactions auto-immunes, comme le syndrome de Guilain-Barré sont très rares (2,4 cas pour 100 000 personnes par an en France26). Les situations qui pourraient éventuellement être liées à l’usage d’un vaccin sont encore plus rares, mais difficilement quantifiables car de nombreux autres événements en sont certainement la cause.
Conclusion
Pour conclure, ces technologies vaccinales s’appuient sur un corpus scientifique substanciel. Si quelques risques existent malgré tout, ils ne viennent pas ajouter une différence notable à ceux auxquels notre organisme est exposé chaque jour face à des microorganismes ou d’autres antigènes environnementaux de toute sorte.

Dessins : Xavier Bernapel - Scénario et textes : Thomas Waag
Références
1. Singh K, Mehta S. The clinical development process for a novel preventive vaccine: An overview. J Postgrad Med. 2016;62(1):4-11. doi:10.4103/0022-3859.173187
2. Clinical vaccine development. Han S. Clin Exp Vaccine Res. 2015 Jan; 4(1):46-53.
3. Stone CA Jr, Rukasin CRF, Beachkofsky TM, Phillips EJ. Immune-mediated adverse reactions to vaccines. Br J Clin Pharmacol. 2019 Dec;85(12):2694-2706. doi: 10.1111/bcp.14112. Epub 2019 Nov 5. PMID: 31472022; PMCID: PMC6955412.
4. Petráš M, Lesná IK, Dáňová J, Čelko AM. Is an Increased Risk of Developing Guillain-Barré Syndrome Associated with Seasonal Influenza Vaccination? A Systematic Review and Meta-Analysis. Vaccines (Basel). 2020 Mar 27;8(2):150. doi: 10.3390/vaccines8020150. PMID: 32230964; PMCID: PMC7349742.
5. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 31;383(27):2603-2615. doi: 10.1056/NEJMoa2034577. Epub 2020 Dec 10. PMID: 33301246; PMCID: PMC7745181.
6. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, Diemert D, Spector SA, Rouphael N, Creech CB, McGettigan J, Kehtan S, Segall N, Solis J, Brosz A, Fierro C, Schwartz H, Neuzil K, Corey L, Gilbert P, Janes H, Follmann D, Marovich M, Mascola J, Polakowski L, Ledgerwood J, Graham BS, Bennett H, Pajon R, Knightly C, Leav B, Deng W, Zhou H, Han S, Ivarsson M, Miller J, Zaks T; COVE Study Group. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2020 Dec 30:NEJMoa2035389. doi: 10.1056/NEJMoa2035389. Epub ahead of print. PMID: 33378609; PMCID: PMC7787219.
7. Keddie S, Pakpoor J, Mousele C, Pipis M, Machado PM, Foster M, Record CJ, Keh RYS, Fehmi J, Paterson RW, Bharambe V, Clayton LM, Allen C, Price O, Wall J, Kiss-Csenki A, Rathnasabapathi DP, Geraldes R, Yermakova T, King-Robson J, Zosmer M, Rajakulendran S, Sumaria S, Farmer SF, Nortley R, Marshall CR, Newman EJ, Nirmalananthan N, Kumar G, Pinto AA, Holt J, Lavin TM, Brennan KM, Zandi MS, Jayaseelan DL, Pritchard J, Hadden RDM, Manji H, Willison HJ, Rinaldi S, Carr AS, Lunn MP. Epidemiological and cohort study finds no association between COVID-19 and Guillain-Barré syndrome. Brain. 2020 Dec 14:awaa433. doi: 10.1093/brain/awaa433. Epub ahead of print. PMID: 33313649.
8. Classen JB, Classen DC. Public should be told that vaccines may have long term adverse effects. BMJ (Clinical Research ed.). 1999 Jan;318(7177):193. DOI: 10.1136/bmj.318.7177.193.
9. Chatterjee A, ed. Vaccinophobia and vaccine controversies of the 21st century. New York: Springer, 2013:1–13.
10. Martinon, F., Krishnan, S., Lenzen, G., Magné, R., Gomard, E., Guillet, J.G., Lévy, J.P., and Meulien, P. (1993). Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. Eur. J. Immunol. 23, 1719–1722.
11. Maruggi G, Zhang C, Li J, Ulmer JB, Yu D. mRNA as a Transformative Technology for Vaccine Development to Control Infectious Diseases. Mol Ther. 2019 Apr 10;27(4):757-772. doi: 10.1016/j.ymthe.2019.01.020. Epub 2019 Feb 7. PMID: 30803823; PMCID: PMC6453507.
12. Kutzler MA, Weiner DB. DNA vaccines: ready for prime time? Nat Rev Genet. 2008 Oct;9(10):776-88. doi: 10.1038/nrg2432. PMID: 18781156; PMCID: PMC4317294.
13. Karikó K, Muramatsu H, Welsh FA, Ludwig J, Kato H, Akira S, Weissman D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther. 2008 Nov;16(11):1833-40. doi: 10.1038/mt.2008.200. Epub 2008 Sep 16. PMID: 18797453; PMCID: PMC2775451.
14. Zhang L, Richards A, Khalil A, Wogram E, Ma H, Young RA, Jaenisch R. SARS-CoV-2 RNA reverse-transcribed and integrated into the human genome. bioRxiv [Preprint]. 2020 Dec 13:2020.12.12.422516. doi: 10.1101/2020.12.12.422516. PMID: 33330870; PMCID: PMC7743078.
15. Honda, T.; Tomonaga, K. Endogenous non-retroviral RNA virus elements evidence a novel type of antiviral immunity. Mob. Genet. Elements2016, 6, e1165785.
16. Douville, R.N.; Nath, A. Human endogenous retroviruses and the nervous system. Handb. Clin. Neurol. 2014, 123, 465–485.
17. Liu MA. A Comparison of Plasmid DNA and mRNA as Vaccine Technologies. Vaccines (Basel). 2019 Apr 24;7(2):37. doi: 10.3390/vaccines7020037. PMID: 31022829; PMCID: PMC6631684.
18. Kuderer, N. M., Choueiri, T. K., Shah, D. P., Shyr, Y., Rubinstein, S. M., Rivera, D. R., Shete, S., Hsu, C. Y., Desai, A., de Lima Lopes, G., Jr., et al. (2020) Clinical impact of COVID-19 on patients with cancer (CCC19): a cohort study. Lancet 395 (10241), 1907−1918.
19. Hoffmann, M., Kleine-Weber, H., Schroeder, S., Kruger, N., Herrler, T., Erichsen, S., Schiergens, T. S., Herrler, G., Wu, N. H., Nitsche, A., Muller, M. A., Drosten, C., and Pohlmann, S. (2020) SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 181 (2), 271− 280.
20. Klinman DM, Klaschik S, Tross D, Shirota H, Steinhagen F. FDA guidance on prophylactic DNA vaccines: analysis and recommendations. Vaccine. 2010 Apr 1;28(16):2801-5. doi: 10.1016/j.vaccine.2009.11.025. Epub 2009 Nov 24. PMID: 19941989; PMCID: PMC2847045.
21. Moustafa A, Xie C, Kirkness E, Biggs W, Wong E, Turpaz Y, Bloom K, Delwart E, Nelson KE, Venter JC, Telenti A. The blood DNA virome in 8,000 humans. PLoS Pathog. 2017 Mar 22;13(3):e1006292. doi: 10.1371/journal.ppat.1006292. PMID: 28328962; PMCID: PMC5378407.
22. Gómez Román, V. R., Murray, J. C. & Weiner, L. M. Antibody-Dependent Cellular Cytotoxicity (ADCC). in Antibody Fc: Linking Adaptive and Innate Immunity (2013). doi:10.1016/B978-0-12- 394802-1.00001-7
23. Kozma GT, Shimizu T, Ishida T, Szebeni J. Anti-PEG antibodies: Properties, formation, testing and role in adverse immune reactions to PEGylated nano-biopharmaceuticals. Adv Drug Deliv Rev. 2020;154-155:163-175. doi: 10.1016/j.addr.2020.07.024. Epub 2020 Aug 1. PMID: 32745496.
24. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2020-12/slides-12-19/05-COVID-CLARK.pdf
25. Jackson, L. A. et al. An mRNA Vaccine against SARS-CoV-2 —Preliminary Report. N. Engl. J. Med. (2020). doi:10.1056/nejmoa2022483
26. Delannoy, Rudant - Incidence du syndrome de Guillain-Barré en France : une analyse épidémiologique à partir des données du PMSI (2008–2013) - REVUE D’EPIDÉMIOLOGIE ET DE SANTÉ PUBLIQUE 2017 - Doi : 10.1016/j.respe.2017.01.010